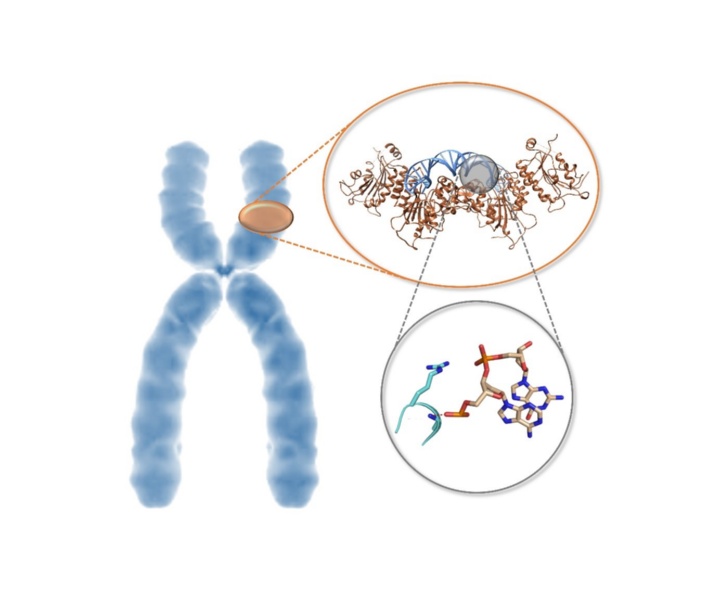
Das ICF-Syndrom ist eine genetisch bedingte Entwicklungsstörung, die unter anderem zu einer Immunschwäche führt und daher die Anfälligkeit der Betroffenen für andere Erkrankungen erhöht. Schon vor rund 20 Jahren zeigten bahnbrechende genetische Beobachtungen, dass der Schlüssel für diese Erkrankung in einer unzureichenden Aktivität des Enzyms DNMT3B liegt. Ein internationales Forschungsteam um Prof. Albert Jeltsch vom Institut für Biochemie und Technische Biochemie (IBTB) der Universität Stuttgart konnte diese Zusammenhänge nun aus biochemisch-molekularer Sicht erklären.
Im Zuge der Evolution von höheren Organismen wie Säugetieren kommt es häufig zu Genduplikationen. Die dabei entstehenden „Zwillingsgene“ haben zwar eine sehr ähnliche Erbsubstanz, sind aber voneinander unabhängig und können sich deshalb auf bestimmte Aufgaben spezialisieren. Ein Beispiel hierfür ist die DNA-Methylierung, eine chemische Abänderung an den Grundbausteinen der Erbsubstanz einer Zelle, die durch die Übertragung von Methylgruppen durch Enzyme (DNA-Methyltransferasen, DNMT) an bestimmte Stellen der DNA bewirkt wird. Zwei Ausprägungen dieser Enzyme in menschlichen Zellen, die aus einer Genduplikation hervorgegangen sind, sind die DNA-Methyltransferasen DNMT3A und DNMT3B.
Zu geringe Aktivität von DNMT3B
Vor über 20 Jahren wurde entdeckt, dass DNMT3B essentiell für die DNA- Methylierung bestimmter Regionen im humanen Genom ist und eine zu geringe Aktivität von DNMT3B zum so genannten ICF Syndrom führt. Warum aber speziell DNMT3B für diese Aufgabe benötigt wird, und nicht zum Beispiel der Zwilling DNMT3A diese Aufgabe übernehmen kann, blieb bisher unbekannt.
In Kooperation mit Gruppen von der University of California und der University of North Carolina at Chapel Hill konnte das Team um Prof. Albert Jeltsch von der Universität Stuttgart nun die Struktur der DNMT3B im Komplex mit anderen DNA-Sequenzen aufklären und die Umsatzrate der DNA-Methylierung von DNMT3B und DNMT3A an Tausenden von DNA-Sequenzen messen. Dabei zeigte sich, dass DNMT3B aufgrund einer speziellen Proteinschleife besonders aktiv an seinen Zielsequenzen im humanen Genom ist, während DNMT3A an diesen Sequenzen nur schlecht arbeiten kann.
Rolle von DNMT3A
Andererseits beeinflussen Mutationen in derselben Proteinschleife in DNMT3A die auch Eigenschaften dieses Enzyms, was zu einer erhöhten Anfälligkeit für Tumore führt. „Es ist spannend zu verstehen, wie sich komplexe Funktionen auf molekularer Ebene in der Evolution entwickeln. Wenn man die Rolle von DNMT3A besser versteht, könnte man in Zukunft zum Beispiel in der Krebstherapie auf einen Enzym-Inhibitor setzen, der das Tumorwachstum eindämmt“, hofft Jeltsch.
Fachlicher Kontakt:
Prof. Dr. Albert Jeltsch, Universität Stuttgart, Institut für Biochemie und Technische Biochemie, Tel: +49 711 685 64390,
E-Mail
Originalpublikation:
Linfeng Gao et.al.: Comprehensive structure-function characterization of DNMT3B and DNMT3A reveals distinctive de novo DNA methylation mechanisms, Nature Communications vom 3.7.2020, DOI 10.1038/s41467-020-17109-4, https://rdcu.be/b5o56